ESTADOS DE ENERGIAS QUÂNTICO DE GRACELI.
se tem sensibilidades térmicas diferentes conforme os tipos de materiais e tipos de energias que são empregadas, provando assim que os estados de energias e quântico variam conforme são empregadas tipos diferenciados de energias.
ou seja, com amesma temperatura se tem sensibilidades variadas conforme esta temperaura foi produzida sobre um esmo material.
e o mesmo acorre sobre materiais diferenciados.
ou seja, estados de energias variados em mesmos materiais, e também em materiais diferenciados.
se tem sensibilidades térmicas diferentes conforme os tipos de materiais e tipos de energias que são empregadas, provando assim que os estados de energias e quântico variam conforme são empregadas tipos diferenciados de energias.
ou seja, com amesma temperatura se tem sensibilidades variadas conforme esta temperaura foi produzida sobre um esmo material.
e o mesmo acorre sobre materiais diferenciados.
ou seja, estados de energias variados em mesmos materiais, e também em materiais diferenciados.
X
TERCEIRA QUANTIZAÇÃO PELO SDCTIE GRACELI
TRANS-QUÂNTICA SDCTIE GRACELI, TRANSCENDENTE, RELATIVISTA SDCTIE GRACELI, E TRANS-INDETERMINADA.
FUNDAMENTA-SE EM QUE TODA FORMA DE REALIDADE SE ENCONTRA EM TRANSFORMAÇÕES, INTERAÇÕES, TRANSIÇÕES DE ESTADOS [ESTADOS DE GRACELI], ENERGIAS E FENÔMENOS DENTRO DE UM SISTEMA DE DEZ OU MAIS DIMENSÕES DE GRACELI, E CATEGORIAS DE GRACELI.
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS =
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
x
[EQUAÇÃO DE DIRAC].
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE RADIOATIVIDADE
, + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ ENTROPIA REVERSÍVEL
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
ENERGIA DE PLANCK
X
-
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......
ΤDCG
X
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
sistema de dez dimensões de Graceli +
DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..
-
-
DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.
x
sistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].
x
número atômico, estrutura eletrônica, níveis de energia
- TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
-
T l T l E l Fl dfG l
X
[ESTADO QUÂNTICO]
X
TODA FORMA DE FUNÇÃO E EQUAÇÃO EM:
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE RADIOATIVIDADE
, + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ ENTROPIA REVERSÍVEL
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
ENERGIA DE PLANCK
X
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli +DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
número atômico, estrutura eletrônica, níveis de energia
- TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- DT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLl
X
[ESTADO QUÂNTICO]
X
TODA FORMA DE FUNÇÃO E EQUAÇÃO EM:
Lei de Boyle[editar | editar código-fonte]
 Ver artigo principal: Lei de Boyle
Para uma certa quantidade de gás a temperatura constante, sua pressão é inversamente proporcional ao volume que ocupa.
Matematicamente:
Ver artigo principal: Lei de Boyle
Para uma certa quantidade de gás a temperatura constante, sua pressão é inversamente proporcional ao volume que ocupa.
Matematicamente:
Para uma certa quantidade de gás a temperatura constante, sua pressão é inversamente proporcional ao volume que ocupa.
Matematicamente:
Lei de Charles[editar | editar código-fonte]
 Ver artigo principal: Lei de Charles
A uma pressão dada, o volume ocupado por uma certa quantidade de um gás é diretamente proporcional a sua temperatura.
Matematicamente:
Ver artigo principal: Lei de Charles
A uma pressão dada, o volume ocupado por uma certa quantidade de um gás é diretamente proporcional a sua temperatura.
Matematicamente:
- ou .
A uma pressão dada, o volume ocupado por uma certa quantidade de um gás é diretamente proporcional a sua temperatura.
Matematicamente:
- ou .
Lei de Gay-Lussac[editar | editar código-fonte]
 Ver artigo principal: Lei de Gay-Lussac
A pressão de uma certa quantidade de gás, que se mantém a volume constante, é diretamente proporcional à temperatura:
Ver artigo principal: Lei de Gay-Lussac
A pressão de uma certa quantidade de gás, que se mantém a volume constante, é diretamente proporcional à temperatura:
A pressão de uma certa quantidade de gás, que se mantém a volume constante, é diretamente proporcional à temperatura:
Lei de Dalton[editar | editar código-fonte]
 Ver artigo principal: Lei de Dalton
A pressão de uma mistura de gases é igual a soma das pressões de todos os gases constituintes.
Matematicamente:
Ptotal = P1 + P2 + ... + Pn
Ver artigo principal: Lei de Dalton
A pressão de uma mistura de gases é igual a soma das pressões de todos os gases constituintes.
Matematicamente:
Ptotal = P1 + P2 + ... + Pn
A pressão de uma mistura de gases é igual a soma das pressões de todos os gases constituintes.
Matematicamente:
Ptotal = P1 + P2 + ... + Pn
2ª Lei: Transformação Isovolumétrica[editar | editar código-fonte]
É também conhecida por isocórica[1] ou isomérica, e ocorre quando o volume de um dado gás permanece constante, mas com variações de temperatura que acarretam em variações de pressão. Também relaciona o volume de substâncias gasosas antes e depois da ocorrência de reações químicas. Tem o seguinte enunciado:
- Tem-se então a relação:
onde:
- é a pressão do gas.
- é a temperatura termodinâmica.
- é uma constante.
Portanto para comparar a mesma substância em estados diferentes (estando de acordo com as condições acima) afirma-se que:
Em uma transformação isovolumétrica, o aumento da pressão do gás ocorre devido ao aumento das colisões entre moléculas, quando a temperatura aumenta. Esse efeito pode ser notado, por exemplo, nos pneus de borracha, pois quando a sua temperatura aumenta, a pressão no interior dos pneus também se eleva. Daí então a importância da calibragem regular dos pneus, a fim de regular os níveis de pressão.
Essa relação entre variáveis foi publicada em 1802, baseada no estudo desenvolvido cerca de 20 anos antes pelo também francês Jacques Charles, à quem foi atribuída a descoberta da relação entre temperatura e volume de um certo gás, com pressão constante, conhecida por '''Lei de Charles''. Devido à essa semelhança, é comumente encontrado na literatura a nomenclatura "Lei de Gay-Lussac e Charles".A semelhança entre leis também permitiu que Gay-Lussac e Lord Kelvin estabelecessem o valor de zero absoluto de temperatura, resultando assim na criação da escala Kelvin.[2]
É também conhecida por isocórica[1] ou isomérica, e ocorre quando o volume de um dado gás permanece constante, mas com variações de temperatura que acarretam em variações de pressão. Também relaciona o volume de substâncias gasosas antes e depois da ocorrência de reações químicas. Tem o seguinte enunciado:
- Tem-se então a relação:
onde:
- é a pressão do gas.
- é a temperatura termodinâmica.
- é uma constante.
Portanto para comparar a mesma substância em estados diferentes (estando de acordo com as condições acima) afirma-se que:
Em uma transformação isovolumétrica, o aumento da pressão do gás ocorre devido ao aumento das colisões entre moléculas, quando a temperatura aumenta. Esse efeito pode ser notado, por exemplo, nos pneus de borracha, pois quando a sua temperatura aumenta, a pressão no interior dos pneus também se eleva. Daí então a importância da calibragem regular dos pneus, a fim de regular os níveis de pressão.
Essa relação entre variáveis foi publicada em 1802, baseada no estudo desenvolvido cerca de 20 anos antes pelo também francês Jacques Charles, à quem foi atribuída a descoberta da relação entre temperatura e volume de um certo gás, com pressão constante, conhecida por '''Lei de Charles''. Devido à essa semelhança, é comumente encontrado na literatura a nomenclatura "Lei de Gay-Lussac e Charles".A semelhança entre leis também permitiu que Gay-Lussac e Lord Kelvin estabelecessem o valor de zero absoluto de temperatura, resultando assim na criação da escala Kelvin.[2]
3ª Lei: Transformação Isobárica[editar | editar código-fonte]
É uma das leis das transformações gasosas, cujo enunciado diz:
Obtendo, assim, a seguinte relação:
Para a compreensão da Lei de Gay-Lussac, considere um gás em um recipiente com uma tampa que seja móvel. Dessa forma, se aquece o gás, deixando a tampa livre. Com o aumento da temperatura, é possível notar a expansão do gás, resultando na elevação da tampa e, em consequência, o aumento do volume. Então, se a temperatura aumenta, o volume também deve aumentar. E vice-versa. Para que a pressão permaneça constante.
É uma das leis das transformações gasosas, cujo enunciado diz:
Obtendo, assim, a seguinte relação:
Para a compreensão da Lei de Gay-Lussac, considere um gás em um recipiente com uma tampa que seja móvel. Dessa forma, se aquece o gás, deixando a tampa livre. Com o aumento da temperatura, é possível notar a expansão do gás, resultando na elevação da tampa e, em consequência, o aumento do volume. Então, se a temperatura aumenta, o volume também deve aumentar. E vice-versa. Para que a pressão permaneça constante.
Curiosidade[editar | editar código-fonte]
A junção das leis de Gay-Lussac, Charles e Boyle e a lei de Avogadro, formam a lei dos gases ideais.
A junção das leis de Gay-Lussac, Charles e Boyle e a lei de Avogadro, formam a lei dos gases ideais.
Relação para teoria cinética e os gases ideais[editar | editar código-fonte]
A lei de Boyle-Mariotte afirma que à temperatura constante para uma quantidade fixa de massa, a pressão absoluta e o volume de um gás são inversamente proporcionais. A lei também pode ser definida de uma maneira um pouco diferente: que o produto entre volume e pressão é sempre constante.
A maioria dos gases se comporta como gases ideais a pressões e temperaturas moderadas. A tecnologia do século XVII não podia produzir pressões altas ou temperaturas muito baixas. Portanto, a lei não aparentava ter limitações no momento da publicação. Conforme avanços tecnológicos permitiam pressões maiores e temperaturas menores, desvios do comportamento de gás ideal tornaram-se notáveis, e a relação entre pressão e volume somente pode ser descrita com precisão utilizando-se a teoria do gás ideal.[7] O desvio é relacionado com o coeficiente de compressibilidade.
Robert Boyle (e Edme Mariotte) obtiveram a lei somente de forma experimental. A lei pode ser obtida também de forma teórica baseada na existência de átomos e moléculas e assumindo colisões perfeitamente elásticas (veja teoria cinética dos gases). No entanto estas suposições eram vistas com enorme resistência entre a comunidade científica positivista da época, sendo vistas somente como construções puramente teóricas para as quais não havia a menor evidência observacional.
Daniel Bernoulli em 1737–1738 deduziu a lei de Boyle-Mariotte utilizando as leis de Newton com aplicação a nível molecular. Ela permaneceu ignorada até por volta de 1845, quando John Waterston realizou uma publicação construindo os maiores princípios da teoria cinética; este foi rejeitado pela Royal Society. Posteriormente trabalhos de James Prescott Joule, Rudolf Clausius e em particular de Ludwig Boltzmann estabeleceram firmemente a teoria cinética dos gases e trouxe o foco para ambas as teorias de Bernoulli e Waterston.[8]
O debate entre defensores do energética e atomismo levaram Boltzmann a escrever um livro em 1898, que enfrentou criticas até o seu suicídio em 1906.[8] Albert Einstein, em 1905, mostrou como a teoria cinética se aplicava ao movimento browniano de uma partícula de fluido suspenso, que foi confirmada em 1908 por Jean Perrin.[8]
A lei de Boyle-Mariotte afirma que à temperatura constante para uma quantidade fixa de massa, a pressão absoluta e o volume de um gás são inversamente proporcionais. A lei também pode ser definida de uma maneira um pouco diferente: que o produto entre volume e pressão é sempre constante.
A maioria dos gases se comporta como gases ideais a pressões e temperaturas moderadas. A tecnologia do século XVII não podia produzir pressões altas ou temperaturas muito baixas. Portanto, a lei não aparentava ter limitações no momento da publicação. Conforme avanços tecnológicos permitiam pressões maiores e temperaturas menores, desvios do comportamento de gás ideal tornaram-se notáveis, e a relação entre pressão e volume somente pode ser descrita com precisão utilizando-se a teoria do gás ideal.[7] O desvio é relacionado com o coeficiente de compressibilidade.
Robert Boyle (e Edme Mariotte) obtiveram a lei somente de forma experimental. A lei pode ser obtida também de forma teórica baseada na existência de átomos e moléculas e assumindo colisões perfeitamente elásticas (veja teoria cinética dos gases). No entanto estas suposições eram vistas com enorme resistência entre a comunidade científica positivista da época, sendo vistas somente como construções puramente teóricas para as quais não havia a menor evidência observacional.
Daniel Bernoulli em 1737–1738 deduziu a lei de Boyle-Mariotte utilizando as leis de Newton com aplicação a nível molecular. Ela permaneceu ignorada até por volta de 1845, quando John Waterston realizou uma publicação construindo os maiores princípios da teoria cinética; este foi rejeitado pela Royal Society. Posteriormente trabalhos de James Prescott Joule, Rudolf Clausius e em particular de Ludwig Boltzmann estabeleceram firmemente a teoria cinética dos gases e trouxe o foco para ambas as teorias de Bernoulli e Waterston.[8]
O debate entre defensores do energética e atomismo levaram Boltzmann a escrever um livro em 1898, que enfrentou criticas até o seu suicídio em 1906.[8] Albert Einstein, em 1905, mostrou como a teoria cinética se aplicava ao movimento browniano de uma partícula de fluido suspenso, que foi confirmada em 1908 por Jean Perrin.[8]
Equação[editar | editar código-fonte]
A equação matemática da lei de Boyle-Mariotte é:
onde:
Enquanto a temperatura permanecer constante a mesma quantidade de energia permanece através da operação e portanto, teoricamente, o valor de k permanecerá constante. No entanto, devido a derivação da pressão como força perpendicular aplicada e a probabilística probabilidade de colisão com outras partículas através da teoria das colisões, a aplicação de força a uma superfície pode não ser infinitamente constante para certos valores de k, mas terá um limite quando tais valores são diferenciados em um dado tempo.
Forçando a aumentar o volume V de uma quantidade fixa de gás, mantendo o gás a temperatura inicial, a pressão P deve diminuir proporcionalmente. Reciprocamente, reduzir o volume do gás aumenta a pressão.
A lei de Boyle é usada para prever o resultado de se introduzir uma mudança, somente de volume ou pressão, a um estado inicial de uma quantidade fixa de gás. O volume e a pressão antes e depois da quantidade fixa de gás, onde as temperaturas antes e depois são iguais (aquecimento ou resfriamento serão necessários para alcançar essas condições), estão relacionadas pela equação:
Aqui, e representam a pressão e volume originais, respectivamente, e e representam a segunda pressão e volume.
As lei de Boyle, lei de Charles, e lei de Gay-Lussac formam, juntamente com a lei de Avogadro, a lei dos gases ideais.
Um gás de Bose ideal é uma versão quântica de um gás ideal clássico. Ele é composto de bósons, partículas que têm um valor inteiro de spin, e portanto obedecem a estatística de Bose-Einstein. A mecânica estatística de bósons foi desenvolvida por Satyendra Nath Bose para fótons, e estendida posteriormente por Albert Einstein para partículas massivas. Einstein percebeu que um gás ideal de bósons iria se condensar quando a temperatura fosse baixa o suficiente, o que não ocorre com um gás ideal clássico. Esta fase da matéria ficou conhecida como Condensado de Bose-Einstein.
A equação matemática da lei de Boyle-Mariotte é:
onde:
Enquanto a temperatura permanecer constante a mesma quantidade de energia permanece através da operação e portanto, teoricamente, o valor de k permanecerá constante. No entanto, devido a derivação da pressão como força perpendicular aplicada e a probabilística probabilidade de colisão com outras partículas através da teoria das colisões, a aplicação de força a uma superfície pode não ser infinitamente constante para certos valores de k, mas terá um limite quando tais valores são diferenciados em um dado tempo.
Forçando a aumentar o volume V de uma quantidade fixa de gás, mantendo o gás a temperatura inicial, a pressão P deve diminuir proporcionalmente. Reciprocamente, reduzir o volume do gás aumenta a pressão.
A lei de Boyle é usada para prever o resultado de se introduzir uma mudança, somente de volume ou pressão, a um estado inicial de uma quantidade fixa de gás. O volume e a pressão antes e depois da quantidade fixa de gás, onde as temperaturas antes e depois são iguais (aquecimento ou resfriamento serão necessários para alcançar essas condições), estão relacionadas pela equação:
Aqui, e representam a pressão e volume originais, respectivamente, e e representam a segunda pressão e volume.
As lei de Boyle, lei de Charles, e lei de Gay-Lussac formam, juntamente com a lei de Avogadro, a lei dos gases ideais.
Um gás de Bose ideal é uma versão quântica de um gás ideal clássico. Ele é composto de bósons, partículas que têm um valor inteiro de spin, e portanto obedecem a estatística de Bose-Einstein. A mecânica estatística de bósons foi desenvolvida por Satyendra Nath Bose para fótons, e estendida posteriormente por Albert Einstein para partículas massivas. Einstein percebeu que um gás ideal de bósons iria se condensar quando a temperatura fosse baixa o suficiente, o que não ocorre com um gás ideal clássico. Esta fase da matéria ficou conhecida como Condensado de Bose-Einstein.
Potencial termodinâmico[editar | editar código-fonte]
Devido a Interação de troca, a maneira mais simples de trabalhar com gases quânticos é com o ensemble grande canônico:
que para um gás fica:
A segunda soma é restrita ao número total de partículas ser . Uma maneira de fazer tal soma é somar primeiro sobre todos os possíveis e depois multiplicar todos os níveis. Para um sistema de bósons, qualquer valor de é permitido, logo:
O potencial termodinâmico é então:
Se o gás possuir apenas graus de liberdade translacionais em dimensões (os demais casos podem ser tratados de forma análoga):
Note que a função polilogarítmica só está definida para reais menores ou iguais a 1. O segundo termo que já estava presente na expressão anterior é a contribuição de momento zero, ou seja, do estado de menor energia.
Devido a Interação de troca, a maneira mais simples de trabalhar com gases quânticos é com o ensemble grande canônico:
que para um gás fica:
A segunda soma é restrita ao número total de partículas ser . Uma maneira de fazer tal soma é somar primeiro sobre todos os possíveis e depois multiplicar todos os níveis. Para um sistema de bósons, qualquer valor de é permitido, logo:
O potencial termodinâmico é então:
Se o gás possuir apenas graus de liberdade translacionais em dimensões (os demais casos podem ser tratados de forma análoga):
Note que a função polilogarítmica só está definida para reais menores ou iguais a 1. O segundo termo que já estava presente na expressão anterior é a contribuição de momento zero, ou seja, do estado de menor energia.
Condensação de Bose-Einstein[editar | editar código-fonte]
O gás de bósons é o sistema mais simples que apresenta o fenômeno de condensação de Bose-Einstein. Para ver esse efeito, escrevemos o número médio de partículas:
O maior valor da função polilogarítmica acontece em quando o número de partículas em estados excitados é:
Perceba que para isso é um número finito que é atingido numa certa temperatura . Todas as demais
partículas deverão estar no estado fundamental, não importando quantas sejam (contanto que a aproximação de gás continue valendo).
O abrandamento de átomos por meio de arrefecimento produz um estado quântico único conhecido como condensado de Bose ou condensado de Bose-Einstein. Este fenômeno foi teorizado nos anos 20 por Albert Einstein, ao generalizar o trabalho de Satyendra Nath Bose sobre a mecânica estatística dos Fótons (sem massa) para átomos (com massa). (O manuscrito de Einstein, que se pensava estar perdido, foi encontrado em 2005 numa biblioteca da Universidade de Leiden). O resultado do trabalho de Bose e Einstein é o conceito de gás de Bose, governado pela estatística de Bose-Einstein que descreve a distribuição estatística de partículas idênticas de spin inteiro, conhecidas hoje em dia como Bósons. As partículas bosónicas, que incluem o Fóton e átomos como o He-4, podem partilhar estados quânticos umas com as outras. Einstein especulou que arrefecendo os átomos bosónicos até temperaturas muito baixas os faria colapsar (ou "condensar") para o mais baixo estado quântico acessível, resultando numa nova forma de matéria.
Esta transição ocorre abaixo de uma temperatura crítica, a qual, para um gás tridimensional uniforme consistindo em partículas não-interactivas e sem graus internos de liberdade aparentes, é dada por:
onde:
é a temperatura crítica, a densidade da partícula, a massa por bóson, a constante de Planck, a constante de Boltzmann, e a função zeta de Riemann; ≈ 2,6124.
Dentro da estrutura que a física estatística possibilita, segue-se que com a ajuda de conjuntos estatísticos para um número médio de ocupação dos estados com a energia da estatística de Fermi-Dirac:
Onde é o potencial químico, a temperatura e a constante de Boltzmann.
Estes férmions, que estão sujeitos ao princípio de exclusão de Pauli, podem estar na condição de máxima ocupação, ou seja . Esta condição é que a estatística de Fermi-Dirac tratará para qualquer valor de preenchimento pleno , porque o potencial químico de um gás ideal de Fermi não é sujeito a quaisquer restrições.
O gás de bósons é o sistema mais simples que apresenta o fenômeno de condensação de Bose-Einstein. Para ver esse efeito, escrevemos o número médio de partículas:
O maior valor da função polilogarítmica acontece em quando o número de partículas em estados excitados é:
Perceba que para isso é um número finito que é atingido numa certa temperatura . Todas as demais
partículas deverão estar no estado fundamental, não importando quantas sejam (contanto que a aproximação de gás continue valendo).
O abrandamento de átomos por meio de arrefecimento produz um estado quântico único conhecido como condensado de Bose ou condensado de Bose-Einstein. Este fenômeno foi teorizado nos anos 20 por Albert Einstein, ao generalizar o trabalho de Satyendra Nath Bose sobre a mecânica estatística dos Fótons (sem massa) para átomos (com massa). (O manuscrito de Einstein, que se pensava estar perdido, foi encontrado em 2005 numa biblioteca da Universidade de Leiden). O resultado do trabalho de Bose e Einstein é o conceito de gás de Bose, governado pela estatística de Bose-Einstein que descreve a distribuição estatística de partículas idênticas de spin inteiro, conhecidas hoje em dia como Bósons. As partículas bosónicas, que incluem o Fóton e átomos como o He-4, podem partilhar estados quânticos umas com as outras. Einstein especulou que arrefecendo os átomos bosónicos até temperaturas muito baixas os faria colapsar (ou "condensar") para o mais baixo estado quântico acessível, resultando numa nova forma de matéria.
Esta transição ocorre abaixo de uma temperatura crítica, a qual, para um gás tridimensional uniforme consistindo em partículas não-interactivas e sem graus internos de liberdade aparentes, é dada por:
onde:
é a temperatura crítica, a densidade da partícula, a massa por bóson, a constante de Planck, a constante de Boltzmann, e a função zeta de Riemann; ≈ 2,6124. Dentro da estrutura que a física estatística possibilita, segue-se que com a ajuda de conjuntos estatísticos para um número médio de ocupação dos estados com a energia da estatística de Fermi-Dirac:Onde é o potencial químico, a temperatura e a constante de Boltzmann.Estes férmions, que estão sujeitos ao princípio de exclusão de Pauli, podem estar na condição de máxima ocupação, ou seja . Esta condição é que a estatística de Fermi-Dirac tratará para qualquer valor de preenchimento pleno , porque o potencial químico de um gás ideal de Fermi não é sujeito a quaisquer restrições.
Tipos de gases ideais[editar | editar código-fonte]
Existem três classes básicas de gases ideais:
- o clássico ou gás ideal de Maxwell-Boltzmann;
- o gás de Bose quântico ideal, composto de bósons; e
- o gás de Fermi quântico ideal, composto de férmions.
O gás ideal clássico pode ser separado em dois tipos: O gás ideal termodinâmico clássico e o gás ideal quântico de Boltzmann. Ambos são essencialmente o mesmo, exceto que o gás ideal termodinâmico é baseado na mecânica estatística clássica , e certos parâmetros tais como a entropia são somente especificados dentro de uma constante aditiva indeterminada. O gás ideal quântico de Boltzmann supera esta limitação, tomando o limite do gás quântico de Bose e o gás quântico de Fermi no limite de alta temperatura para especificar estas constantes aditivas. O comportamento de um gás quântico de Boltzmann é o mesmo que de um gás ideal clássico, exceto para a especificação destas constantes. Os resultados do gás quântico de Boltzmann são utilizados num certo número de casos, incluindo a equação de Sackur-Tetrode para a entropia de um gás ideal e a equação de ionização Saha para um plasma fracamente ionizado.
- Existem três classes básicas de gases ideais:
- o clássico ou gás ideal de Maxwell-Boltzmann;
- o gás de Bose quântico ideal, composto de bósons; e
- o gás de Fermi quântico ideal, composto de férmions.
O gás ideal clássico pode ser separado em dois tipos: O gás ideal termodinâmico clássico e o gás ideal quântico de Boltzmann. Ambos são essencialmente o mesmo, exceto que o gás ideal termodinâmico é baseado na mecânica estatística clássica , e certos parâmetros tais como a entropia são somente especificados dentro de uma constante aditiva indeterminada. O gás ideal quântico de Boltzmann supera esta limitação, tomando o limite do gás quântico de Bose e o gás quântico de Fermi no limite de alta temperatura para especificar estas constantes aditivas. O comportamento de um gás quântico de Boltzmann é o mesmo que de um gás ideal clássico, exceto para a especificação destas constantes. Os resultados do gás quântico de Boltzmann são utilizados num certo número de casos, incluindo a equação de Sackur-Tetrode para a entropia de um gás ideal e a equação de ionização Saha para um plasma fracamente ionizado.
Gás ideal simples[editar | editar código-fonte]
Um gás ideal simples pode ser completamente caracterizado apenas pelos seguinte parâmetros macroscópicos: energia interna, volume e número de moles de seus constituintes.
Um gás ideal simples é caracterizado por duas equações:
-
-
Onde:
- é uma constante;
- é a constante universal dos gases ();
- é a energia interna do sistema;
- é o número de moles dos componestes químicos;
- é a temperatura do sistema.
Gases compostos de átomos monoatômicos não interagentes (tais como He, Ar, Ne) satisfazem essas equações em temperaturas tais que seja pequeno quando comparado com as energias de excitação eletrônica e em pressões baixas ou moderadas. Para tais gases ideais monoatômicos .
- Um gás ideal simples pode ser completamente caracterizado apenas pelos seguinte parâmetros macroscópicos: energia interna, volume e número de moles de seus constituintes.
Um gás ideal simples é caracterizado por duas equações:Onde:- é uma constante;
- é a constante universal dos gases ();
- é a energia interna do sistema;
- é o número de moles dos componestes químicos;
- é a temperatura do sistema.
Gases compostos de átomos monoatômicos não interagentes (tais como He, Ar, Ne) satisfazem essas equações em temperaturas tais que seja pequeno quando comparado com as energias de excitação eletrônica e em pressões baixas ou moderadas. Para tais gases ideais monoatômicos . -
Leis que regem os gases ideais termodinâmicos clássicos[editar | editar código-fonte]
Um gás ideal termodinâmico clássico obedece às seguintes leis:
Lei Pub. Condições Enunciado Lei de Boyle-Mariotte 1662 Lei de Charles 1802 Lei de Gay-Lussac 1809 Lei de Avogadro 1811 Substância pura
Onde:
- representa a pressão;
- representa o volume;
- representa a temperatura termodinâmica;
- representa a quantidade de gás;
- representa a massa.
- Um gás ideal termodinâmico clássico obedece às seguintes leis:
Lei Pub. Condições Enunciado Lei de Boyle-Mariotte 1662 Lei de Charles 1802 Lei de Gay-Lussac 1809 Lei de Avogadro 1811 Substância pura Onde:- representa a pressão;
- representa o volume;
- representa a temperatura termodinâmica;
- representa a quantidade de gás;
- representa a massa.
Equação de Clapeyron[editar | editar código-fonte]
Unificando todos os enunciados obtemos que:
Essa relação define a constante dos gases perfeitos () que vale 8,314 J·K−1mol−1 para todos os gases perfeitos. Daí vem a equação de estado dos gases perfeitos, conhecida como equação de Clapeyron:
O nome dessa formulação é uma referência a Benoît Paul-Émile Clapeyron.
Os gases reais são todos os gases existentes na natureza, salvo quando estão em condições de pressão e de temperatura particulares e nestes casos são considerados aproximadamente, para efeitos apenas de cálculos facilitados, como gases perfeitos ou ideais. Em oposição aos gases ideais, os gases reais não podem ser explicados e modelados inteiramente usando-se a lei dos gases ideais.
Os gases nobres, como hélio e o argônio, por serem gases atômicos, não formando normalmente moléculas, são mais próximos dos gases ideais, e por isso, até erroneamente, chamados no passado de "gases perfeitos", pois suas partículas se comportam mais como as características idealizadas e pontuais dos gases ideais.[1]
Para entender-se e modelar-se gases reais diversas condições devem ser consideradas, como:
- Efeitos de compressibilidade;
- Capacidade térmica específica variável;
- Forças de Van der Waals;
- Efeitos de não equilíbrio termodinâmico;
- Problemas com a dissociação molecular e reações elementares com composição variável.
Para a maioria das aplicações, tal análise detalhada é desnecessária, e a aproximação dos gases ideais por ser usada com razoável precisão. Modelos de gases reais tem de ser usados próximos dos pontos de condensação dos gases, próximo do ponto crítico, a altíssimas pressões, e em alguns outros casos menos usuais.
Para tratar-se fisicamente os gases reais, diversas equações de estado adequadas aos gases reais foram propostas:
Introduz-se também o coeficiente de compressibilidade Z para medir a não idealidade dos gases reais.
- Unificando todos os enunciados obtemos que:Essa relação define a constante dos gases perfeitos () que vale 8,314 J·K−1mol−1 para todos os gases perfeitos. Daí vem a equação de estado dos gases perfeitos, conhecida como equação de Clapeyron:O nome dessa formulação é uma referência a Benoît Paul-Émile Clapeyron.Os gases reais são todos os gases existentes na natureza, salvo quando estão em condições de pressão e de temperatura particulares e nestes casos são considerados aproximadamente, para efeitos apenas de cálculos facilitados, como gases perfeitos ou ideais. Em oposição aos gases ideais, os gases reais não podem ser explicados e modelados inteiramente usando-se a lei dos gases ideais.Os gases nobres, como hélio e o argônio, por serem gases atômicos, não formando normalmente moléculas, são mais próximos dos gases ideais, e por isso, até erroneamente, chamados no passado de "gases perfeitos", pois suas partículas se comportam mais como as características idealizadas e pontuais dos gases ideais.[1]Para entender-se e modelar-se gases reais diversas condições devem ser consideradas, como:
- Efeitos de compressibilidade;
- Capacidade térmica específica variável;
- Forças de Van der Waals;
- Efeitos de não equilíbrio termodinâmico;
- Problemas com a dissociação molecular e reações elementares com composição variável.
Para a maioria das aplicações, tal análise detalhada é desnecessária, e a aproximação dos gases ideais por ser usada com razoável precisão. Modelos de gases reais tem de ser usados próximos dos pontos de condensação dos gases, próximo do ponto crítico, a altíssimas pressões, e em alguns outros casos menos usuais.Para tratar-se fisicamente os gases reais, diversas equações de estado adequadas aos gases reais foram propostas:Introduz-se também o coeficiente de compressibilidade Z para medir a não idealidade dos gases reais.
Índice
Modelos[editar | editar código-fonte]
 Ver artigo principal: Equação de estado
Ver artigo principal: Equação de estado
 Ver artigo principal: Equação de estado
Ver artigo principal: Equação de estado
Modelo de van der Waals[editar | editar código-fonte]
 Ver artigo principal: Equação de van der Waals
Gases reais são frequentemente modelados por levar-se em conta seus peso molar e volume molar:
.
Nesta equação P é a pressão, T é a temperatura, R a constante dos gases ideais, e Vm o volume molar. a e b são parâmetros que são determinados empiricamente para cada gás, mas são algumas vezes estimados de sua temperatura crítica (Tc) e pressão crítica (Pc) usando-se estas relações:
Ver artigo principal: Equação de van der Waals
Gases reais são frequentemente modelados por levar-se em conta seus peso molar e volume molar:
.
Nesta equação P é a pressão, T é a temperatura, R a constante dos gases ideais, e Vm o volume molar. a e b são parâmetros que são determinados empiricamente para cada gás, mas são algumas vezes estimados de sua temperatura crítica (Tc) e pressão crítica (Pc) usando-se estas relações:
 Ver artigo principal: Equação de van der WaalsGases reais são frequentemente modelados por levar-se em conta seus peso molar e volume molar:.Nesta equação P é a pressão, T é a temperatura, R a constante dos gases ideais, e Vm o volume molar. a e b são parâmetros que são determinados empiricamente para cada gás, mas são algumas vezes estimados de sua temperatura crítica (Tc) e pressão crítica (Pc) usando-se estas relações:
Ver artigo principal: Equação de van der WaalsGases reais são frequentemente modelados por levar-se em conta seus peso molar e volume molar:.Nesta equação P é a pressão, T é a temperatura, R a constante dos gases ideais, e Vm o volume molar. a e b são parâmetros que são determinados empiricamente para cada gás, mas são algumas vezes estimados de sua temperatura crítica (Tc) e pressão crítica (Pc) usando-se estas relações:
Modelo de Redlich–Kwong[editar | editar código-fonte]
 Ver artigo principal: Equação de estado de Redlich–Kwong
A equação de Redlich–Kwong é outra equação de dois parâmetros que é usada para modelar gases reais. É quase sempre mais precisa que a equação de van der Waals, e frequentemente mais precisa que alguma equação com mais que dois parâmetros. A equação é
.
Nesta equação a e b são dois parâmetros empíricos que não são os mesmos parâmetros usados na equação de van der Waals.
Ver artigo principal: Equação de estado de Redlich–Kwong
A equação de Redlich–Kwong é outra equação de dois parâmetros que é usada para modelar gases reais. É quase sempre mais precisa que a equação de van der Waals, e frequentemente mais precisa que alguma equação com mais que dois parâmetros. A equação é
.
Nesta equação a e b são dois parâmetros empíricos que não são os mesmos parâmetros usados na equação de van der Waals.
 Ver artigo principal: Equação de estado de Redlich–KwongA equação de Redlich–Kwong é outra equação de dois parâmetros que é usada para modelar gases reais. É quase sempre mais precisa que a equação de van der Waals, e frequentemente mais precisa que alguma equação com mais que dois parâmetros. A equação é.Nesta equação a e b são dois parâmetros empíricos que não são os mesmos parâmetros usados na equação de van der Waals.
Ver artigo principal: Equação de estado de Redlich–KwongA equação de Redlich–Kwong é outra equação de dois parâmetros que é usada para modelar gases reais. É quase sempre mais precisa que a equação de van der Waals, e frequentemente mais precisa que alguma equação com mais que dois parâmetros. A equação é.Nesta equação a e b são dois parâmetros empíricos que não são os mesmos parâmetros usados na equação de van der Waals.
Modelo de Berthelot e modelo modificado de Berthelot[editar | editar código-fonte]
A equação de Berthelot é muito raramente usada, , mas a versão modificada é algo mais precisa:
- A equação de Berthelot é muito raramente usada, , mas a versão modificada é algo mais precisa:
Modelo de Dieterici[editar | editar código-fonte]
Este modelo tem deixado de ser usado nos últimos anos
- Este modelo tem deixado de ser usado nos últimos anos
Modelo de Clausius[editar | editar código-fonte]
A equação de Clausius é uma equação de três parâmetros muito simples usada para modelar gases:
.
Nesta equação, , e .
- A equação de Clausius é uma equação de três parâmetros muito simples usada para modelar gases:.Nesta equação, , e .
Modelo virial[editar | editar código-fonte]
 Ver artigo principal: Equação do virial
A equação virial deriva de um tratamento perturbativo de mecânica estatística:
ou alternativamente
.
A, B, C, A′, B′, e C′ são constantes dependentes da temperatura.
Ver artigo principal: Equação do virial
A equação virial deriva de um tratamento perturbativo de mecânica estatística:
ou alternativamente
.
A, B, C, A′, B′, e C′ são constantes dependentes da temperatura.
 Ver artigo principal: Equação do virialA equação virial deriva de um tratamento perturbativo de mecânica estatística:ou alternativamente.A, B, C, A′, B′, e C′ são constantes dependentes da temperatura.
Ver artigo principal: Equação do virialA equação virial deriva de um tratamento perturbativo de mecânica estatística:ou alternativamente.A, B, C, A′, B′, e C′ são constantes dependentes da temperatura.
Modelo Peng-Robinson[editar | editar código-fonte]
Esta equação de dois parâmetros tem a interessante característica de ser útil em modelar alguns líquidos assim como gases reais:
.
- Esta equação de dois parâmetros tem a interessante característica de ser útil em modelar alguns líquidos assim como gases reais:.
Modelo de Wohl[editar | editar código-fonte]
A equação de Wohl é formulada em termos de valores críticos, fazendo-a útil quando constantes de gases reais não estão disponíveis:
Nesta equação , e .
- A equação de Wohl é formulada em termos de valores críticos, fazendo-a útil quando constantes de gases reais não estão disponíveis:Nesta equação , e .
Modelo de Beattie-Bridgeman[editar | editar código-fonte]
A equação de Beattie-Bridgeman é expressa por:
.
Nesta equação d é a densidade molar e a, b, c, A, e B são parâmetros empíricos.
- A equação de Beattie-Bridgeman é expressa por:.Nesta equação d é a densidade molar e a, b, c, A, e B são parâmetros empíricos.
Modelo de Benedict-Webb-Rubin[editar | editar código-fonte]
A equação de Benedict-Webb-Rubin, chamada também chamada equação BWR e algumas vezes referida como equação BWRS:
Onde d é a densidade molar e a, b, c, A, B, C, α, e γ são parâmetros empíricos.
Calor específico é uma grandeza física intensiva que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. A unidade no SI é (joule por quilograma e por kelvin). Uma unidade usual bastante utilizada para calores específicos é cal/(g.°C) (caloria por grama e por grau Celsius).[1]
Em rigor há dois calores específicos distintos: o calor específico a volume constante e o calor específico a pressão constante . O calor específico a pressão constante é geralmente um pouco maior do que o calor específico a volume constante, sendo a afirmação verdadeira para materiais com coeficientes de dilatação volumétrico positivos. Em virtude do aumento de volume associado à dilatação térmica, parte da energia fornecida na forma de calor é usada para realizar trabalho contra o ambiente a pressão constante e não para aumentar a temperatura em si; o aumento de temperatura experimentado para um sistema à pressão constante é pois menor do que aquele que seria experimentado pelo mesmo sistema imposto o volume constante uma vez mantida a mesma transferência de energia na forma de calor. No caso do calor específico a volume constante, toda a energia recebida na forma de calor é utilizada para elevar a temperatura do sistema, o que faz com que — em virtude de sua definição — seja um pouco menor. A diferença entre os dois é particularmente importante em gases; em sólidos e líquidos sujeitos a pequenas variações de volume frente às variações de temperatura, os valores dos dois na maioria das vezes se confundem por aproximação. Em análise teórica e de precisão, contudo, é importante a diferenciação dos dois.
Materiais com dilatação anômala, como a água entre 0 °C e 4 °C, não obedecem à regra anterior; nestes casos o calor específico a volume constante é então um pouco maior do que o calor específico a pressão constante.
- A equação de Benedict-Webb-Rubin, chamada também chamada equação BWR e algumas vezes referida como equação BWRS:Onde d é a densidade molar e a, b, c, A, B, C, α, e γ são parâmetros empíricos.Calor específico é uma grandeza física intensiva que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. A unidade no SI é (joule por quilograma e por kelvin). Uma unidade usual bastante utilizada para calores específicos é cal/(g.°C) (caloria por grama e por grau Celsius).[1]Em rigor há dois calores específicos distintos: o calor específico a volume constante e o calor específico a pressão constante . O calor específico a pressão constante é geralmente um pouco maior do que o calor específico a volume constante, sendo a afirmação verdadeira para materiais com coeficientes de dilatação volumétrico positivos. Em virtude do aumento de volume associado à dilatação térmica, parte da energia fornecida na forma de calor é usada para realizar trabalho contra o ambiente a pressão constante e não para aumentar a temperatura em si; o aumento de temperatura experimentado para um sistema à pressão constante é pois menor do que aquele que seria experimentado pelo mesmo sistema imposto o volume constante uma vez mantida a mesma transferência de energia na forma de calor. No caso do calor específico a volume constante, toda a energia recebida na forma de calor é utilizada para elevar a temperatura do sistema, o que faz com que — em virtude de sua definição — seja um pouco menor. A diferença entre os dois é particularmente importante em gases; em sólidos e líquidos sujeitos a pequenas variações de volume frente às variações de temperatura, os valores dos dois na maioria das vezes se confundem por aproximação. Em análise teórica e de precisão, contudo, é importante a diferenciação dos dois.Materiais com dilatação anômala, como a água entre 0 °C e 4 °C, não obedecem à regra anterior; nestes casos o calor específico a volume constante é então um pouco maior do que o calor específico a pressão constante.
Índice
Definição[editar | editar código-fonte]
O calor específico () de uma substância pode ser definido a partir da capacidade térmica () de um corpo composto por ela como o quociente desta pela massa () desse corpo.[2] Matematicamente,
A capacidade térmica, por sua vez, é definida como a razão entre calor recebido e variação de temperatura observada. Assim, o calor específico pode ser expresso como:
Por essa última relação, nota-se que o calor específico depende do processo pelo qual o calor é cedido à substância. Usando a primeira lei da termodinâmica, com sendo a pressão, pode-se escrever:
Dois casos particulares são de maior importância. Um deles é o calor específico a volume constante, onde o termo representando o trabalho () é nulo, e pela relação anterior
O segundo caso é o calor específico a pressão constante. Nesse caso, a equação anterior resulta em
,
A distinção entre esses dois calores específicos pode normalmente ser ignorada nas fases sólida e líquida, dado que essas substâncias normalmente sofrem uma variação de volume muito pequena. Gases, no entanto, apresentam grande expansão térmica, sendo sempre necessária a distinção entre ambos os calores específicos.
- O calor específico () de uma substância pode ser definido a partir da capacidade térmica () de um corpo composto por ela como o quociente desta pela massa () desse corpo.[2] Matematicamente,A capacidade térmica, por sua vez, é definida como a razão entre calor recebido e variação de temperatura observada. Assim, o calor específico pode ser expresso como:Por essa última relação, nota-se que o calor específico depende do processo pelo qual o calor é cedido à substância. Usando a primeira lei da termodinâmica, com sendo a pressão, pode-se escrever:Dois casos particulares são de maior importância. Um deles é o calor específico a volume constante, onde o termo representando o trabalho () é nulo, e pela relação anteriorO segundo caso é o calor específico a pressão constante. Nesse caso, a equação anterior resulta em,A distinção entre esses dois calores específicos pode normalmente ser ignorada nas fases sólida e líquida, dado que essas substâncias normalmente sofrem uma variação de volume muito pequena. Gases, no entanto, apresentam grande expansão térmica, sendo sempre necessária a distinção entre ambos os calores específicos.
Calor específico molar[editar | editar código-fonte]
Em muitas circunstâncias a unidade mais conveniente para especificar a quantidade de uma substancia é o mol, definido como sendo uma quantidade de 6,02 x 1023 unidades elementares de qualquer substância. Assim, por exemplo um mol de alumínio significa 6,02 x 1023 átomos de alumínio (o átomo é a unidade elementar), e 1 mol de óxido de alumínio significa 6,02 x 1023 fórmulas moleculares do composto.
Nesses casos, quando a quantidade de substância é expressa em moles, utiliza-se o chamado calor específico molar, que é expresso como sendo a capacidade térmica por mol.[4] De forma análoga com o calor específico por massa, o calor específico molar depende do processo ao qual a substância é submetida; define-se de mesma forma as quantidades a pressão constante e a volume constante.
- Em muitas circunstâncias a unidade mais conveniente para especificar a quantidade de uma substancia é o mol, definido como sendo uma quantidade de 6,02 x 1023 unidades elementares de qualquer substância. Assim, por exemplo um mol de alumínio significa 6,02 x 1023 átomos de alumínio (o átomo é a unidade elementar), e 1 mol de óxido de alumínio significa 6,02 x 1023 fórmulas moleculares do composto.Nesses casos, quando a quantidade de substância é expressa em moles, utiliza-se o chamado calor específico molar, que é expresso como sendo a capacidade térmica por mol.[4] De forma análoga com o calor específico por massa, o calor específico molar depende do processo ao qual a substância é submetida; define-se de mesma forma as quantidades a pressão constante e a volume constante.
Calor específico molar a volume constante[editar | editar código-fonte]
O calor específico molar a volume constante é definido como:
Sendo que,
(primeira lei da termodinâmica) com o trabalho temos ,por se tratar de um processo a volume constante.
onde:
- é o calor absorvido ou cedido por uma amostra de moles de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
Para um gás monoatômico ideal,
- O calor específico molar a volume constante é definido como:Sendo que,(primeira lei da termodinâmica) com o trabalho temos ,por se tratar de um processo a volume constante.onde:
- é o calor absorvido ou cedido por uma amostra de moles de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
Para um gás monoatômico ideal,
Calor específico molar a pressão constante[editar | editar código-fonte]
O calor específico molar a pressão constante é definido como:
Sendo que temos as seguintes relações:
(primeira lei da termodinâmica) e . Relacionando o trabalho com a equação dos gases ideais ficamos com . Substituindo a as respectivas equações mais a equação na equação ficamos com
onde:
- é o calor absorvido ou cedido por uma amostra de mols de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
- O calor específico molar a pressão constante é definido como:Sendo que temos as seguintes relações:(primeira lei da termodinâmica) e . Relacionando o trabalho com a equação dos gases ideais ficamos com . Substituindo a as respectivas equações mais a equação na equação ficamos comonde:
- é o calor absorvido ou cedido por uma amostra de mols de um gás;
- é a variação de temperatura resultante;
- é a variação de energia interna.
Regra de Dulong-Petit[editar | editar código-fonte]
A regra de Dulong-Petit consiste em obter, aproximadamente, o calor específico das substâncias por meio da massa molar:
Em que:
- é o calor específico, em joule por quilograma kelvin (J.kg−1.K−1);
- é a constante dos gases reais, equivalente a 8,31 joules por mol kelvin (J.K−1.mol−1);
- é a massa molar, em quilograma por mol (kg/mol).
- A regra de Dulong-Petit consiste em obter, aproximadamente, o calor específico das substâncias por meio da massa molar:Em que:
- é o calor específico, em joule por quilograma kelvin (J.kg−1.K−1);
- é a constante dos gases reais, equivalente a 8,31 joules por mol kelvin (J.K−1.mol−1);
- é a massa molar, em quilograma por mol (kg/mol).
Unidades[editar | editar código-fonte]
Sistema internacional[editar | editar código-fonte]
A unidade SI para calor específico é joule por kelvin por quilograma (J / K / kg, J / (kg K), JK -1 kg -1 , etc.). Como um incremento de temperatura de um grau Celsius é o mesmo que um incremento de um kelvin, é o mesmo que joule por grau Celsius por quilograma (J / ° C / kg). Às vezes, o grama é usado em vez de quilograma para a unidade de massa: 1 J / K / kg = 0,001 J / K / g.
O calor específico de uma substância (por unidade de massa) tem dimensão L 2 · T − 2 · Θ −1 ou (L / T) 2 / Θ. Portanto, a unidade SI J / K / kg é equivalente ao metro quadrado por segundo ao quadrado por kelvin (m 2 K −1 s −2 ).
- A unidade SI para calor específico é joule por kelvin por quilograma (J / K / kg, J / (kg K), JK -1 kg -1 , etc.). Como um incremento de temperatura de um grau Celsius é o mesmo que um incremento de um kelvin, é o mesmo que joule por grau Celsius por quilograma (J / ° C / kg). Às vezes, o grama é usado em vez de quilograma para a unidade de massa: 1 J / K / kg = 0,001 J / K / g.O calor específico de uma substância (por unidade de massa) tem dimensão L 2 · T − 2 · Θ −1 ou (L / T) 2 / Θ. Portanto, a unidade SI J / K / kg é equivalente ao metro quadrado por segundo ao quadrado por kelvin (m 2 K −1 s −2 ).
Unidades de engenharia inglesas (imperiais)[editar | editar código-fonte]
Profissionais da construção , engenharia civil , engenharia química e outras disciplinas técnicas, especialmente no Estados Unidos , pode utilizar os chamados unidades de Inglês Engenharia , que incluem a imperial libra (lb = 0,45459237 kg) como unidade de massa, o grau Fahrenheit ou Rankine (° F = 5/9 K, cerca de 0,555556 K) como a unidade de incremento de temperatura, e a unidade térmica britânica (BTU ≈ 1055.06 J), [5] [6] como a unidade de calor.
- Profissionais da construção , engenharia civil , engenharia química e outras disciplinas técnicas, especialmente no Estados Unidos , pode utilizar os chamados unidades de Inglês Engenharia , que incluem a imperial libra (lb = 0,45459237 kg) como unidade de massa, o grau Fahrenheit ou Rankine (° F = 5/9 K, cerca de 0,555556 K) como a unidade de incremento de temperatura, e a unidade térmica britânica (BTU ≈ 1055.06 J), [5] [6] como a unidade de calor.
Medição do calor específico de uma substância[editar | editar código-fonte]
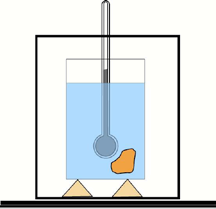
A capacidade calorífica de um corpo é determinada com ajuda de um calorímetro e um termômetro. Um calorímetro simples (veja a figura) consiste num cilindro metálico polido, colocado num outro cilindro metálico sobre cortiça (para isolamento térmico).[7]
O calor específico de uma substância é normalmente determinado de acordo com a definição; ou seja, medindo a capacidade térmica de uma amostra da substância, geralmente com um calorímetro , e dividindo pela massa da amostra. Várias técnicas podem ser aplicadas para estimar a capacidade térmica de uma substância como, por exemplo, calorimetria de varredura diferencial rápida . [8] [9]
O cilindro interno é enchido com água ou algum outro líquido de calor específico conhecido. Um corpo de massa m, e capacidade calorífica específica c, aquecido a uma certa temperatura T é imergido no calorímetro de massa m1 e capacidade calorífica c1 na qual a temperatura é medida. Suponha que a temperatura deste líquido de m2 e capacidade calorífica específica c2 no calorímetro é T’ antes de o corpo ser emergido nele, e quando a temperatura do líquido e do corpo é a mesma, a temperatura torna-se Tf.
Da lei de conservação da energia e considerando o calor dissipado na vizinhança pelo objecto quente Q, o calor recebido pela água e pelo calorímetro que seja respectivamente Q1 e Q2 , mostra que a capacidade calorífica específica é
- A capacidade calorífica de um corpo é determinada com ajuda de um calorímetro e um termômetro. Um calorímetro simples (veja a figura) consiste num cilindro metálico polido, colocado num outro cilindro metálico sobre cortiça (para isolamento térmico).[7]O calor específico de uma substância é normalmente determinado de acordo com a definição; ou seja, medindo a capacidade térmica de uma amostra da substância, geralmente com um calorímetro , e dividindo pela massa da amostra. Várias técnicas podem ser aplicadas para estimar a capacidade térmica de uma substância como, por exemplo, calorimetria de varredura diferencial rápida . [8] [9]O cilindro interno é enchido com água ou algum outro líquido de calor específico conhecido. Um corpo de massa m, e capacidade calorífica específica c, aquecido a uma certa temperatura T é imergido no calorímetro de massa m1 e capacidade calorífica c1 na qual a temperatura é medida. Suponha que a temperatura deste líquido de m2 e capacidade calorífica específica c2 no calorímetro é T’ antes de o corpo ser emergido nele, e quando a temperatura do líquido e do corpo é a mesma, a temperatura torna-se Tf.Da lei de conservação da energia e considerando o calor dissipado na vizinhança pelo objecto quente Q, o calor recebido pela água e pelo calorímetro que seja respectivamente Q1 e Q2 , mostra que a capacidade calorífica específica é
Fatores que afetam o calor específico[editar | editar código-fonte]
Moléculas sofrem muitas vibrações características internas. A energia potencial armazenada nestes graus de liberdade internos contribui para uma amostra do conteúdo de energia, mas não a sua temperatura. Graus de liberdade mais internos tendem a aumentar a capacidade de uma substância de calor específico, contanto que as temperaturas são suficientemente elevadas para superar os efeitos quânticos.
- Moléculas sofrem muitas vibrações características internas. A energia potencial armazenada nestes graus de liberdade internos contribui para uma amostra do conteúdo de energia, mas não a sua temperatura. Graus de liberdade mais internos tendem a aumentar a capacidade de uma substância de calor específico, contanto que as temperaturas são suficientemente elevadas para superar os efeitos quânticos.
Graus de liberdade[editar | editar código-fonte]
O comportamento termodinâmico das moléculas dos gases monoatômicos, como hélio, e dos gases diatômicos, como o nitrogênio, é muito diferente. Em gases monoatômicos, a energia interna é unicamente para movimentos de translação. Os movimentos são movimentos de translação em um espaço tridimensional em que as partículas se movem e trocam energia em colisões elásticas da mesma forma como fariam bolas de borracha colocadas num recipiente que foi agitado fortemente. (Veja animação aqui). Estes movimentos nas dimensões X, Y, e Z significam que os gases monoatômicos tem apenas três graus de liberdade de translação. Moléculas com maior atomicidade, no entanto, tem vários graus de liberdade interna, rotacionais e vibracionais. Elas se comportam como uma população de átomos que podem se mover dentro de uma molécula de formas diferentes (veja a animação à direita). A energia interna é armazenada nesses movimentos internos. Por exemplo, o nitrogênio, que é uma molécula diatômica, tem cinco graus de liberdade: três de translação e dois de rotação interna. Note que a calor específico molar a volume constante do gás monoatômico é , sendo R a constante universal do gás ideal, ao passo que para o valor do nitrogênio (diatômico) vale , o que mostra claramente a relação entre os graus de liberdade e ao calor específico.
onde é o número de graus de liberdade.
- O comportamento termodinâmico das moléculas dos gases monoatômicos, como hélio, e dos gases diatômicos, como o nitrogênio, é muito diferente. Em gases monoatômicos, a energia interna é unicamente para movimentos de translação. Os movimentos são movimentos de translação em um espaço tridimensional em que as partículas se movem e trocam energia em colisões elásticas da mesma forma como fariam bolas de borracha colocadas num recipiente que foi agitado fortemente. (Veja animação aqui). Estes movimentos nas dimensões X, Y, e Z significam que os gases monoatômicos tem apenas três graus de liberdade de translação. Moléculas com maior atomicidade, no entanto, tem vários graus de liberdade interna, rotacionais e vibracionais. Elas se comportam como uma população de átomos que podem se mover dentro de uma molécula de formas diferentes (veja a animação à direita). A energia interna é armazenada nesses movimentos internos. Por exemplo, o nitrogênio, que é uma molécula diatômica, tem cinco graus de liberdade: três de translação e dois de rotação interna. Note que a calor específico molar a volume constante do gás monoatômico é , sendo R a constante universal do gás ideal, ao passo que para o valor do nitrogênio (diatômico) vale , o que mostra claramente a relação entre os graus de liberdade e ao calor específico.onde é o número de graus de liberdade.
Massa molar[editar | editar código-fonte]
Uma razão pela qual o calor específico tem valores diferentes para diferentes substâncias é a diferença de massas molares, que é a massa de um mol de qualquer elemento, que é diretamente proporcional à massa molecular do elemento, a soma dos valores das massas atômicas da molécula em questão. A energia térmica é armazenada pela existência de átomos ou moléculas de vibração. Se uma substância tem uma massa molar mais leve, em seguida, cada grama de que tem mais átomos ou moléculas disponíveis para armazenar energia. Esta é a razão pela qual o hidrogênio, a substância com menor massa molar tem um calor específico muito elevado. A consequência deste fenômeno é a de que, quando se mede o calor específico em termos molares a diferença entre substâncias torna-se menos acentuada e o calor específico de hidrogênio para de ser atípico. Da mesma forma, as substâncias moleculares (também absorvem calor em seus graus de liberdade internos) pode armazenar grandes quantidades de energia por mol se é moléculas grandes e complexas, e, portanto, seu calor específico medido em massa é menos perceptível . Uma vez que a densidade média de um elemento químico está fortemente relacionada com a sua massa molar, em termos gerais, há uma forte correlação inversa entre a densidade do sólido e o (calor específico a pressão constante). Lingotes sólidos grandes de baixa densidade tendem a absorver mais calor do que um lingote pequeno de mesma massa, porém com densidade mais elevada que o primeiro, porque contém mais átomos. Por conseguinte, em termos gerais, há uma forte correlação entre o volume de um elemento sólido e a sua capacidade total de calor. No entanto, existem muitos desvios desta correlação.
- Uma razão pela qual o calor específico tem valores diferentes para diferentes substâncias é a diferença de massas molares, que é a massa de um mol de qualquer elemento, que é diretamente proporcional à massa molecular do elemento, a soma dos valores das massas atômicas da molécula em questão. A energia térmica é armazenada pela existência de átomos ou moléculas de vibração. Se uma substância tem uma massa molar mais leve, em seguida, cada grama de que tem mais átomos ou moléculas disponíveis para armazenar energia. Esta é a razão pela qual o hidrogênio, a substância com menor massa molar tem um calor específico muito elevado. A consequência deste fenômeno é a de que, quando se mede o calor específico em termos molares a diferença entre substâncias torna-se menos acentuada e o calor específico de hidrogênio para de ser atípico. Da mesma forma, as substâncias moleculares (também absorvem calor em seus graus de liberdade internos) pode armazenar grandes quantidades de energia por mol se é moléculas grandes e complexas, e, portanto, seu calor específico medido em massa é menos perceptível . Uma vez que a densidade média de um elemento químico está fortemente relacionada com a sua massa molar, em termos gerais, há uma forte correlação inversa entre a densidade do sólido e o (calor específico a pressão constante). Lingotes sólidos grandes de baixa densidade tendem a absorver mais calor do que um lingote pequeno de mesma massa, porém com densidade mais elevada que o primeiro, porque contém mais átomos. Por conseguinte, em termos gerais, há uma forte correlação entre o volume de um elemento sólido e a sua capacidade total de calor. No entanto, existem muitos desvios desta correlação.
As ligações de hidrogênio[editar | editar código-fonte]
Contendo hidrogênio na sua composição, moléculas polares como o etanol, amônia e água, têm poderosas ligações intermoleculares de hidrogênio quando em sua fase líquida. Estas ligações proporcionam um outro local em que o calor pode ser armazenado como energia potencial de vibração, mesmo em baixas temperaturas comparativamente.
- Contendo hidrogênio na sua composição, moléculas polares como o etanol, amônia e água, têm poderosas ligações intermoleculares de hidrogênio quando em sua fase líquida. Estas ligações proporcionam um outro local em que o calor pode ser armazenado como energia potencial de vibração, mesmo em baixas temperaturas comparativamente.
Impurezas[editar | editar código-fonte]
No caso de ligas, existem certas condições em que as pequenas impurezas podem alterar grandemente o calor específico medido. As ligas podem mostrar uma diferença marcada no seu comportamento, mesmo que a impureza em questão seja um dos elementos que formam a liga, tais como ligas impuras em semicondutores ferromagnéticos que podem conduzir a medições muito diferentes.
A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.
Substância Calor Específico (cal/g.°C) água 1,0 álcool 0,58 alumínio 0,22 ar 0,24 carbono 0,12 chumbo 0,031 cobre 0,094 ferro 0,11 gelo 0,5 hélio 1,25 hidrogênio 3,4 latão 0,092 madeira 0,42 mercúrio 0,033 nitrogênio 0,25 ouro 0,032 oxigênio 0,22 prata 0,056 rochas 0,21 vidro 0,16 zinco 0,093
Dissociação eletrolítica, em química, é o processo em que compostos iônicos têm seus íons separados. Estes íons podem voltar a recombinar-se para dar origem ao composto original. Esse processo ocorre apenas com compostos que apresentem ligações iônicas. Este conceito é frequentemente confundido com ionização.
A dissociação ocorre principalmente com bases e sais, como se vê nos exemplos a seguir:
- No caso de ligas, existem certas condições em que as pequenas impurezas podem alterar grandemente o calor específico medido. As ligas podem mostrar uma diferença marcada no seu comportamento, mesmo que a impureza em questão seja um dos elementos que formam a liga, tais como ligas impuras em semicondutores ferromagnéticos que podem conduzir a medições muito diferentes.A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.
Substância Calor Específico (cal/g.°C) água 1,0 álcool 0,58 alumínio 0,22 ar 0,24 carbono 0,12 chumbo 0,031 cobre 0,094 ferro 0,11 gelo 0,5 hélio 1,25 hidrogênio 3,4 latão 0,092 madeira 0,42 mercúrio 0,033 nitrogênio 0,25 ouro 0,032 oxigênio 0,22 prata 0,056 rochas 0,21 vidro 0,16 zinco 0,093 Dissociação eletrolítica, em química, é o processo em que compostos iônicos têm seus íons separados. Estes íons podem voltar a recombinar-se para dar origem ao composto original. Esse processo ocorre apenas com compostos que apresentem ligações iônicas. Este conceito é frequentemente confundido com ionização.A dissociação ocorre principalmente com bases e sais, como se vê nos exemplos a seguir:
Índice
Constante de dissociação[editar | editar código-fonte]
 Ver artigo principal: Constante de dissociação
Supondo uma situação de dissociações reversíveis em um equilíbrio químico
Ver artigo principal: Constante de dissociação
Supondo uma situação de dissociações reversíveis em um equilíbrio químico
-
a constante de dissociação Kd é a relação entre o que foi dissociado pelo que permaneceu associado
-
 Ver artigo principal: Constante de dissociaçãoSupondo uma situação de dissociações reversíveis em um equilíbrio químicoa constante de dissociação Kd é a relação entre o que foi dissociado pelo que permaneceu associado
Ver artigo principal: Constante de dissociaçãoSupondo uma situação de dissociações reversíveis em um equilíbrio químicoa constante de dissociação Kd é a relação entre o que foi dissociado pelo que permaneceu associado-
Sais e óxidos[editar | editar código-fonte]
A dissociação de ácidos pela solvatação em solução aquosa representa a separação entre cátions e ânions. O ácido original pode ser recuperado pela evaporação do solvente ou pela cristalização em um resfriamento.
- A dissociação de ácidos pela solvatação em solução aquosa representa a separação entre cátions e ânions. O ácido original pode ser recuperado pela evaporação do solvente ou pela cristalização em um resfriamento.
 [EQUAÇÃO DE DIRAC].
[EQUAÇÃO DE DIRAC].
 + FUNÇÃO DE RADIOATIVIDADE
+ FUNÇÃO DE RADIOATIVIDADE
 + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ FUNÇÃO DE TUNELAMENTO QUÂNTICO. + ENTROPIA REVERSÍVEL
+ ENTROPIA REVERSÍVEL ![\sigma =q(n\mu _{n}+p\mu _{p})[\Omega .cm]^{{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53d1173dd9d9ec55715f1f4beb1ea5dcd4932bc8) FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA ENERGIA DE PLANCK
ENERGIA DE PLANCK

 [ESTADO QUÂNTICO]
[ESTADO QUÂNTICO]


































![{\displaystyle N^{(p=0)}=N\left[1-\left({\frac {T}{T_{0}}}\right)^{d/2}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef649cbb75c572cc7590dbf97476d8bab371275f)








 dos
dos 
 da
da 
 é o
é o 



































![P=RTd+d^{2}\left(RT(B+bd)-(A+ad-a{\alpha }d^{4})-{\frac {1}{T^{2}}}[C-cd(1+{\gamma }d^{2})\exp(-{\gamma }d^{2})]\right)](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5e5d158536bb8d92f777a5fccf93e1b0713d549)






































![{\displaystyle K_{d}={\frac {[A^{+}]\cdot [B^{-}]}{[AB]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cfb95d7fb23db9bb8193e84045f30a4589e339df)